关于包涵体的复性一直是生物制药的瓶颈,包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化。
一、包涵体蛋白的表达
在平板上挑取单菌落,接种于含有氨苄青霉素和卡那霉素抗性的5 ml LB培养基中,37 ℃过夜培养,然后转接到100 ml LB 培养基中,37 ℃培养至A600 为0.4~0.6时,加入IPTG 至终浓度为0.5
mmol/L 诱导3.5 h。8000 r/min 离心5 min 收集菌体,加入10 ml 50 mmol/LTris-HCl,冰浴下超声波破碎后12000 r/min离心30 min收集沉淀。
二、包涵体的洗涤
在包涵体中加入包涵体洗涤液:50 mmol/L Tris—HCl,1 mmol/L EDTA,50 mmol/LNaCl,w=0.5%TritonX-100,pH 8.0;,37℃振荡洗涤1~2 h,然后8 000 r/min 离心15 min,收集沉淀。
三、包涵体的溶解
洗涤后的包涵体加入适量的
四、包涵体的复性
包涵体的复性目前常用的主要有两种方式:1,稀释溶液,但是操作的液体量大,蛋白稀释;2,透析,超滤或电渗透析去除变性剂。
1.包涵体的稀释复性
设定不同的复性条件:蛋白质量浓度、尿素浓度、温度、氧化还原条件、加入Ttiton X-100与环糊精的量、复性时间等,使变性溶解的包涵体稀释复性,复性一定时间后取样测酶活性。
2.包涵体的透析复性
包涵体蛋白的复性将8 mol/L 尿素溶解后的样品装入透析袋,密封置于复性液I(0.2 mol/L Tris-HCl;0.5 mol/L NaCl;5%甘油;5 μmol/L EDTA;pH8.5),4 ℃
透析12 h 后再转入复性液II(0.2 mol/L Tris-HCl;0.5 mol/L NaCl;)4 ℃ 透析12 h,12000 r/min 离心30 min,收集上清进行蛋白浓度及活性测定。
复性前对蛋白的性质一定要清楚:
1. 蛋白预期的二级结构都是些什么。一般来说beta sheet占多数的蛋白较易复性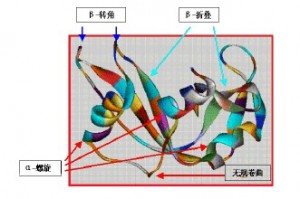
2. 蛋白pI
3. 氨基酸组成,比如有没有cystine
4. 有没有底物?如果有结合的ligand之类,通常加入后会有所帮助,
5. 一般尿素中含有非常高的一种杂质(暂时记不起什么名字了,如果楼主一定要请回帖我再找找),当达到8 M的时候杂质的浓度也很大了。有的实验室会先纯化一下尿素,然后再溶解,有的直接先试GuHCl
6. 复性一般是梯度稀释,或者梯度透析,或者在柱上缓慢降低Urea,一下子降低太快(你的复性液)可能也是原因之一。
7. 盐浓度是否可以再高些?一般可以达到0.5 M,如果有更好的盐(如果这个蛋白的生化性质比较了解的话,应该再加入一些别的盐)
8. 一般会有Glycerol
9. 一般会有Arginine或者glycine
虽然复性成功的例子很多,但是还是建议首先尝试更换载体:pet32a、PGEX、Pmal都有可能促进蛋白可溶,由包涵体表达变成可溶表达。毕竟复性的条件很难摸索,成功的概率太小,浪费的时间也太多。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享