将细胞样品与台盼蓝染料混合。活细胞排斥染料,而死细胞被染成深蓝色。将细胞铺在血球计数器的玻板上,显微镜下进行人工计数。
一、材料
- 血(球)计数计(改进的Neubauer 型),每次用后洗净并晾干。(也可以用其他计数器,只是格子不同。)
- 血(球)计数计的盖玻片(可重复使用),每次用后洗净并晾干。
- 含0.4% (W/V) 台盼蓝的PBS 。
- 计数器
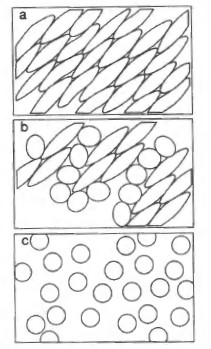
- 悬浮好的细胞(既可以是悬浮生长的细胞,也可以是胰蛋白酶处理的贴壁生长的细胞),确认贴壁生长的细胞已经充分游离成单细胞(见图1) ,涡旋培养瓶后取代表性样本。
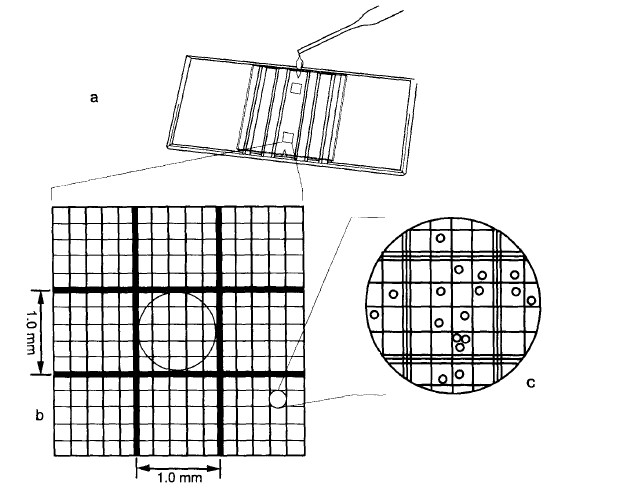
a 用10 X 的物镜观察(总放大倍数为100), 1 mm2 的格子可以完全出现在视野内。每个1 mm2 的格子被分成了25 个小格子。
b. 25 个小格子的每个又被分成了20 个更小的方格,以计数小的或稀少的细胞数。
c. 用1 mm2的小格子的细胞数计算到每毫升细胞数。
- 移液器、移液头。
- 微型离心管。
- 直立或倒置的相差显微镜,10倍物镜。
- 待稀释无菌培养基。
二、步骤
- 将盖玻片平稳地盖在血球计数计的中间。
- 取500 μI 细胞培养液到微型离心管中,如果样品过少就只取100 μI
- 取50 μI 细胞和50 μI 台盼蓝混匀。
- 用移液管取50 μI 混合液,轻轻地在盖玻片的两边滴上20 μI, 让液体通过毛细管现象吸到载玻片上面(如果有两个样品,可以放置两个盖玻片,并小心地分别滴到盖玻片下,即使只有一个样品也要把计数器的两个计数室都填满) 。
- 立刻把计数计放到显微镜的工作台上,在低倍镜下固定一个格子计数,只需计数任何一个1 mm2 格子内的细胞数量, 就可以换到高倍镜下确保视野中有一个完整的方格。低倍镜下也可以计数,但不容易区分活的和死的细胞。如果使用的是倒置显微镜,要降低物镜以得到足够的光线。
- 大致确定格子中的细胞(数2 5 个小格即可),以决定细胞是要稀释还是浓缩。理想的细胞数量是30~300 个/ mm, 如果过多,就以1:5 或1: 10 稀释,(例如10 倍稀释,将步骤2 中50 μI 细胞悬液与450 μI培养基或缓冲液混合,按步骤3 取50 μI 细胞液与50 μI 台盼蓝混合) 。
- 计算1 mm2 格子内的活细胞数量,死细胞会全部被染成蓝色,而活细胞不被染色(可能会有蓝边) 。最好是把两者都数出来,可以计算出活细胞的比例。
- 计数3 个不同的1 mm2 的格子,得到平均值。
- 计算出1 ml 中的细胞数目。
平均值X 10 000 X 稀释倍数= 原始样品中1 ml 的细胞数。
例如
三个格子的细胞数分别为113 、99 和118, 平均为11 0 。
110 X 10 000 = 1.1 X 106
由于细胞和台盼蓝是等体积混合,稀释倍数为2,
2 X 1. 1 X 106 = 2. 2 X 106
所以原液中细胞数目为2.2 X 106 个/ ml 。
- 计算出原细胞悬液中活细胞的比例
计算方法为: (活细胞总数/细胞总数) X100
三、温馨提示
1.没有将悬浮很好的或混合很好的细胞加到计数室内是血球计数氐不能正确计数的主要原因。
2. 如果细胞数小于30, 可以把取出的细胞离心并用小的体积重新悬浮,但是通常不用这样做。数三个格子求平均值即可。
3. 为了避免同一个细胞数两次,只计数每个小格子上部和左边的细胞而不计数右边和下边的细胞。每次计数的时候都要遵循同一规则,这样才能保证每次计数的都一样。
4.如果每次数的细胞数量差别在20% 以上,说明细胞没有完全分散,或有成团的现象。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享