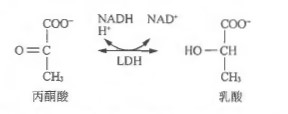
常用的细胞毒性测定方法的基础是测量受损细胞释放的胞浆酶的活性。乳酸脱氢酶
试剂
已转染的哺乳动物细胞
本方法必须做三个重复。对于LDH 法,需要留出一组不经毒性试剂处理的细胞孔以用于估计LDH 的总量。
LDH 检测底物溶液
LDH 标准(可选;见步骤8)
裂解液
终止液[含50% 二甲基甲酰胺
可用lmol/L 盐酸来终止反应,但当用于含酚红的培养基时DMF/SDS 溶液效果更好,因其能够中和背景吸附。
设备
微量滴定板分光光度计
96 孔板,标准平底
96 孔板, V 形底或圆底
组织培养皿
方法
靶细胞数目的优化(总LDH 释放测定)
不同类型的靶细胞(YAC-1 、K562 、Daudi等)含有LDH 的量不同,因此,需要采用实验所需类型的细胞进行预实验,以测定确保足够信噪比所需的最适靶细胞数目。
- 制备靶细胞的稀释液(0细胞/ 100μL 、5000 细胞/100μL 、10000 细胞/ 100μL 和20000 细胞/ 100μL), 向V 形底或圆底96 板的每个孔加入100μL 。做三个重复。
- 向每孔加入15μL 裂解液,将培养板250g 离心4min 。
- 转移50μL 上清至96 孔平底酶联板。
- 向培养基中加入50μL LDH 检测底物。将板子用锡箔覆盖或装入不透明小盒以避光, 37°C 孵育15 ~ 30min 。
- 加入100μL 终止液。
- 确保孔中无气泡。在加入终止液lh 之内测量490nm 处的吸光度。于690nm 处测定背景吸光度,从主波长测量值
- 对于吸光度值至少是培养基对照的背景吸光度两倍的细胞,测定其细胞密度。
- (可选)向50μL 不同的LDH 标准中加入50μL 检测底物。孵育15min, 然后同上测量吸光度。用得到的值制备标准曲线,用于比较待测样品的酶活性。
细胞毒性检测
9.转移50μL 细胞培养上清至96 孔板中。如果是悬浮培养的细胞,则先将细胞250g离心4min, 然后移取50μL 上清。
10 . 向培养基中加入50 μL LDH 检测底物。将板子用锡箔覆盖或装入不透明小盒以避光, 37°C 孵育15 ~ 30min 。
- 加入l00μL 终止液。
12 . 确保孔中无气泡。在加入终止液lh 之内测量490nm 的吸光度。于690nm 测定背景吸光度,从主波长测量值
13 . 用下列等式计算测定细胞死亡百分比(细胞毒性百分比):
细胞毒性(%) =实验组LDH释放量( OD490)/最大LDH释放量(OD490)
- ( 可选)向50μL 不同的LDH 标准中加入50 μL 检测底物。孵育15min , 然后同上测量吸光度。用得到的值制备标准曲线,用于比较待测样品的酶活性。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享