病毒载体最常用的有遍在启动子(ubiquitous promoters) 、细胞类型特异性启动子和多聚腺苷酸化信号。
遍在启动子
• 人类CMV 立即早期启动子
• 小鼠干细胞病毒(MSCV) 启动子
• CMV 增强子与鸡β-actin 启动子融合的CAG 杂合启动子(也称为CGA 、CBA 或CB ;在不同版本中的长度不同)
• 人类EF-α
• 人类磷酸甘油酸激酶1 (PGKl) 启动子
• 泛素启动子
细胞类型特异性启动子
• 用于肝特异表达的α1 抗胰蛋白酶启动子
•用于骨骼肌特异表达的肌肉肌酸激酶(MCK) 启动子
•用于神经元细胞特异表达的人类突触蛋白- 1 (SYN-1) 或大鼠神经元特异性烯醇化酶( NSE) 启动子
•用于肺特异表达的人类Clara 细胞10kDa 蛋白(CC10) 启动子
•用于视网膜特异表达的人类视黄醇类结合蛋白( IRBP) 启动子
病毒载体中常用的多聚腺昔酸化信号
•牛生长激素(BGH)
•兔β球蛋白(RBG)
• SV40
•存在于反转录病毒和慢病毒载体LTR 元件上的天然信号
在表达盒中通常存在内含子以加强转基因表达,包括人工及天然内含子(如RBG 内含子)。
插入转录后调控元件已被证明能提高转基因表达效率。最常用的元件来源于WPRE( Donella et al. 1998 ) 。
将miRNA 的靶序列插入到病毒载体的3’UTR 区将导致外源基因在特定miRNA 高表达的细胞中转录中止。这种方法成功用于阻止体内抗原提呈细胞中外源基因的表达,进而减轻了外源基因诱发的获得性免疫反应。
插入loxP-stop-loxP 盒使在特定细胞类型表达Cre 重组酶的转基因小鼠中进行细胞类型特异性表达。
上图所示载体中在同一启动子下表达两个外源基因。启动子两侧外源基因的表达效率不一定完全相同。这可能不是使两个基因表达效率相同的最好设计(见其他设计),但就研究miRNA 对基因表达的调控来说却是一个很好的设计( Brown and Naldini 2009 ) 。在一个转基因的3 ‘UTR 区引入miRNA 靶序列,在第二个外源基因,可能是标记基因(如GFP ) 基础转录时, 实现miRNA 调控研究。
在这个载体中, 一个转录物中的外源基因表达为天然状态的独立蛋白质。通常情况下,内部核糖体进入位点(IRES) 下游的基因表达效率低于上游基因,但这种情况还是取决于IRES 元件。最常用的IRES 元件来源于脑心肌炎病毒。最近出现的IRES 元件比以前更加高效( Chappell et al. 2000; Wang et al. 2005) 。这类表达盒通常设计为是将目的基因与毒性药物抗性标记基因(如嘌呤霉素、潮霉素、新霉素)或使转导细胞易于鉴定的荧光蛋白共表达。目前,已经开发出多种能够进行荧光和生物发光成像的蛋白质(Wurdinger et al. 2008; Tannous 2009 ) 。
在以上图示中, 一个编码多个蛋白的外源基因被2A 序列/sec 隔开。多聚蛋白质在翻译过程中可自我加工成几个独立的蛋白质,即多个蛋白质的表达可以源于一个多聚蛋白[例如,产生iPS 细胞的4 个必需转录因子(Sommer et al. 2009) ,抗体轻重链可同时表达(Fang et al. 2005) ] 。
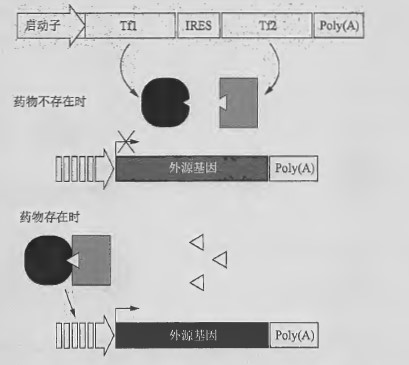
该系统利用双重转录因子复合物调控基因表达。一种质粒/载体携带的外源基因在12个ZFHD-1 结合位点构成诱导性启动子下,再上游是最小IL-2 启动子, 另一种质粒/载体是双顺反子,其编码两个融合蛋白,分别作为转录激活因子和DNA 结合蛋白。雷帕霉素存在时,人FKBP12 和FKBP -雷帕霉素-相关蛋白(FRAP) 结构域二聚体化,形成转录复合物。转录激活因子(Tfl)由人FRAP 蛋白的FRB 结构域与人NF-κB p65 亚基来源的激活结构域融合构成。DNA 结合蛋白(Tf2) 由ZFHDl 的DNA 结合结构域与3 个拷贝的人FKBP12 融合构成(Ye et al. 1999; Rivera et al. 1999) 。
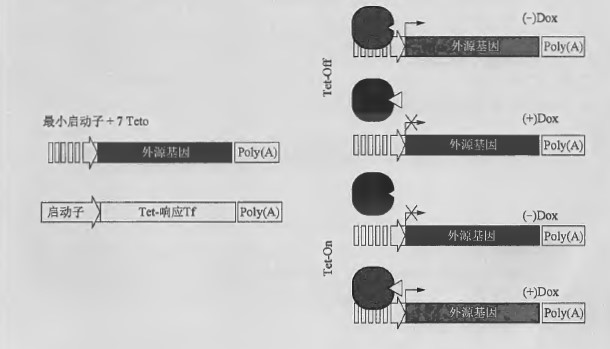
四环素调控的基因表达系统是最早开发用于哺乳动物细胞/组织的表达系统之一,继续被广泛应用于生物学中药物调控的基因表达。该系统应用细菌来源的四环素响应转录因子,由细菌的四环素结合结构域(TetR) 与HSV-1 VP16 的转录激活结构域融合而成。开发了tTA 和rtTA 这2 个转录因子,在四环素或其衍生抗生素如多西环素(doxycycline)存在时, Tet-On 系统(Gossen et al. 1995) 可以结合Tet 同源操纵子(tetO) ;而其不存在时,则Tet-Off 系统(Gossen and Bujard 1992) 可以结合Tet 同源操纵子(tetO) 。优化的Tet-响应转录因子rtTA2s-M2, 表现出极低的tetO 残余结合,且低浓度多西环素就可以最大限度地诱导基因表达(Urlinger et al. 2000) 。
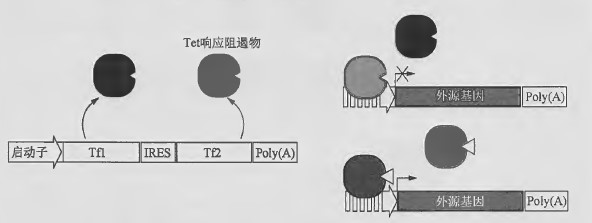
该Tet 调控系统是Tet 响应转录沉默因子(tTSkid)和rtTA 转录激活因子的组合,能够严谨控制几个数量级水平的基因表达(Freundlieb et al. 1999) 。在关闭状态时, tTSkid 使转录活性处于抑制状态。对于存在其他增强子元件可能反式激活Tet-响应启动子从而导致外源基因的高水平基础表达的病毒载体而言,该设计非常重要。目前,该设计已成功应用于多种病毒载体系统(Pluta et al. 2005; Candolfi et al. 2007) 。
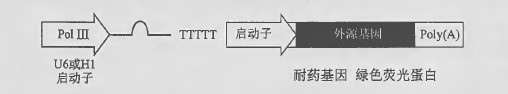
用于RNA 干扰(RNAi) 病毒载体的常见设计基于RNA 聚合酶III (Pol III) 的启动子,如U6 和Hl (Sibley et al. 2010) 。shRNA 的下游是由5 个T 串联组成的终止序列。经剪切酶(Dicer) 加工, shRNA 失去了6bp 环,留下含2bp 突出端的21 bp 双链分子。TetO 序列和Hl 或U6 的组合可实现药物调控的shRNA 表达(Pluta et al. 2007) 。
位于已插入外源基因表达盒3’UTR 区的miRNA 中的shRNA 的表达(Stegmeier et al. 2005) 似乎表现出较低的体内毒性( McBride et al. 2008; Boudreau et al. 2009) 。此外,该设计与大多数外源基因表达盒使用的RNA 聚合酶II 的启动子相容,可以实现许多目标,如组织特异性表达、发育控制或药物控制的表达。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享