反转录病毒载体
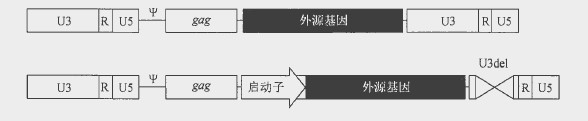
最常用的反转录病毒载体基于Mo -MLV 。第一代载体所携带的转基因的两侧是2 个完整的LTR, 由增强子 、R 区(即转录起始区,在病毒颗粒中的载体基因组两端均存在)及U5 区构成。病毒载体的包装主要由包装信号序列(ψ)介导,而邻近的gag序列能够显著提高其包装效率。所有反转录病毒载体均携带一个ψ甲序列和部分gag 序列组成的扩展包装信号序列,经改造去除了起始密码子。第一代载体由LTR 启动子起始
转录(图中第一个载体)。这些载体的问题之一是在体内经过一段时间后,启动子关闭,这就促使了新一代SIN 反转录病毒载体应运而生,它们携带几乎彻底去除了U3 增强子序列的3′-LTR, 内含起始转录的哺乳动物启动子。在反转录过程中,去除U3 区的基因组载体的3’端复制成5′-LTR 区,从而产生一个无活性LTR 启动子。
慢病毒载体
目前,人类基因治疗和实验室应用的慢病毒载体绝大多数来源于HIV-l, 因此,该类载体的设计都考虑到了安全性。这类载体包含一个与反转录病毒相同的扩展包装信号序列(ψ+gag) ,可以自失活(删除U3 的3′-LTR) ,还携带一个嵌合的5′-LTR 区域,该区域包含源于RSV 或CMV 早期基因启动子的增强序列。这种设计似乎可以显著增加病毒滴度,因此在反转录病毒中也有应用。此外, HIV-1 慢病毒需要RRE 的存在,该序
列对于病毒基因组有效运输到细胞质并高效包装是必需的。如同反转录病毒,慢病毒在其3′-LTR 附近也包含一个多嘌呤序列 ,该位点对于反转录过程中正链DNA 合成的起始是必需的。对携带一个PPT 序列的第一代慢病毒载体的困惑之一是观察到对成人大脑中有丝分裂期后神经细胞的转导要比成人非分裂的肝细胞中高效得多 。不久后发现在慢病毒载体中心区引入的第二个PPT 序列对于有丝分裂后细胞中的前整合复合物的核转位至关重要 。中心区PPT(cPPT) 或中心区DNA“ 瓣” ( flap ) 的引入使慢病毒载体在分裂细胞和非分裂细胞中均可以高效转导遗传信息。目前多数慢病毒载体的另一个元件是肝炎病毒土拨鼠转录后调控元件 ,该元件如果置于转基因序列的正义方向下游,能使表达效率提高5~8 倍 。
AAV 载体
大多数AAV 载体的转基因表达盒的两侧是AAV2ITR,在这些载体上没有源于野生型病毒的其他基因组元件。来自其他血清型AAV 的ITR 元件也很常见 。用ssAAV 载体转导的最大问题是它在转导细胞中转变为有转录活性的dsDNA 。自身互补或dsAAV 载体携带了一个去除末端解离位点的ITR, 使双链基因组包装,快速介导转导后转基因的表达。双链AAV 载体最大可包装约2.4kb, 而传统的单链AAV 载体则可达到4.7 ~4.8kb 。这些载体显示了体内基因表达的高效性和稳定性,而在体外培养的细胞中其作用效果远不及其他载体。
腺病毒载体
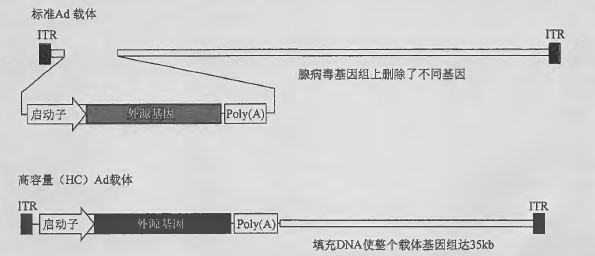
多数腺病毒载体基于Ad5, 携带的转基因表达盒插入El 早期转录单元中,载体上保留了大部分野生型基因组,仅删除了一个或多个早期转录单元(见下文)。大容量腺病毒载体 通常只含有腺病毒ITR 、一个转基因表达盒和填充DNA ,使载体约35kb 。HC-Ad 载体不包含任何源于野生腺病毒基因组的其他遗传元件,不会像Ad 介导的体内基因递送一样,因获得性免疫造成免疫并发症。病毒衣壳激活的先天性免疫仍有待解决。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享