长链dsRNA 的导入能够在小鼠卵母细胞、早期胚胎、胚胎干细胞和胚胎癌细胞
siRNA 设计
最初, siRNA 序列的选择是基于实验经验而获得的
强的siRNA 。
- 目标区域。siRNA 通常以mRNA 的CDS 序列为靶点,因为一般认为,相对非编码序列而言, CDS 序列容易成为RNA 干扰的靶点且多态性更低。然而,当CDS 不容易找到合适的siRNA 结合位点,或者为了区分两个编码区相同但3’非翻译区
- 长度和非配对结构。尽管20 ~ 25 个核苷酸长度、包含2 个非配对碱基形成的3’端突出“尾巴"的双链siRNA 显示出了与常规siRNA 相当的效率,但常规的双链siRNA依然是长度为21 个核苷酸、两端包含2 个非配对碱基形成的3′ 端突出“尾巴",模拟了Dicer 酶体内切割的主要产物。长度超过3 0 个碱基的双链RNA 能够在哺乳动物体细胞中诱导干扰素反应。一些长度超过23 个碱基的RNA 双链体能够诱导细胞特异性的于扰素反应
- 热力学不对称性。进入RISC 的siRNA 链被称为“向导链" 。这一siRNA链的5′ 端碱基配对较为松弛(动力学稳定性稍差),被RNA 干扰机器识别为向导
- GC 含量和核苷酸偏好。有关siRNA 设计的大量分析显示: 具有生物学功能的siRNA不能含有回文
- RNA 干扰介导的脱靶效应。RNA 干扰介导的脱靶效应是指双链siRNA 的向导链或信使链介导的对基因表达的非特异性抑制,具有浓度依赖性(图1) Oackson et al 2006a ) 。RNA 干扰介导的脱靶效应通常会在siRNA 发挥类似内源性mRNA 的作用时发生,即通过小RNA 向导链的“种子序列”
及靶标之外mRNA 的亲和力
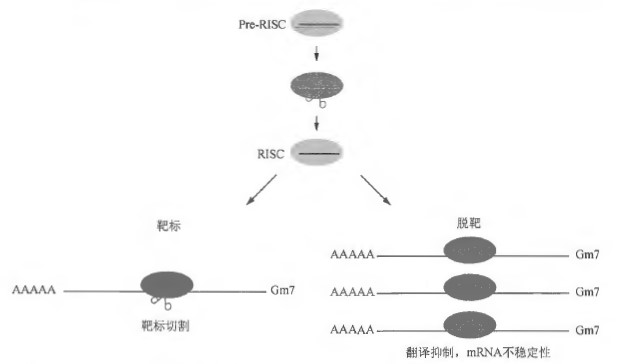
行切割,即通常所说的RNA 干扰过程。但是, siRNA 也可以发挥类似细胞内miRNA 的作用,即通过部分碱基配对与其RNA 靶标相匹配。这种miRNA 的作用偶尔会导致对非靶标m阳寸A 的抑制作用,即脱靶效应。
天然免疫反应和毒性。在哺乳动物中,如果siRNA 包含富含G 和U 的序列基序,如GUCCUUCAA 或者UGUGU, 那么此siRNA 有可能通过Toll 样受体激活细胞内的天然免疫通路
siRNA 的体外制备
化学合成siRNA 。合成siRNA 应用广泛,这种方法的得率和纯度都比较高。对合成siRNA 还可以进行一系列化学修饰以提高siRNA 的稳定性、降低脱靶效应,以及(或者)阻止激活天然免疫反应。
利用酶学反应从长链dsRNA 生成siRNA 。利用重组Dicer 酶或者细菌RNaseⅢ 对体外转录获得的长链dsRNA 进行酶学消化也可以获得双链siRNA
也就无法选择精确的对照,因此,无法区分究竟是既定靶标mRNA 还是脱靶基因的特定表型表达发生下调。
体外转录。利用合成的、含有噬菌体启动子的DNA 寡核苷酸模板,经体外转录可以生成siRNA 。通常,这一方法通过核酸酶或者核酶消化,确保产物拥有确定的末端以及(或者) 5 '端单磷酸或者经基末端。这一方式能够以较低成本快速生成多个不同siRNA ,但是风险主要存在于污染的三磷酸RNA 会触发天然免疫反应
siRNA 、shRNA 和shRNAmir 的细胞内表达
在细胞内利用DNA 模板表达siRNA 、shRNA 和shRNAmir
基于DNA 的siRNA 表达。在基于DNA 的siRNA 表达方法中, siRNA 的有义链和反义链由同一质粒中不同的RNA 聚合酶III 启动子转录而成。转录后,有义链和反义链通过分子内配对形成双链siRNA 并触发RNA 干扰
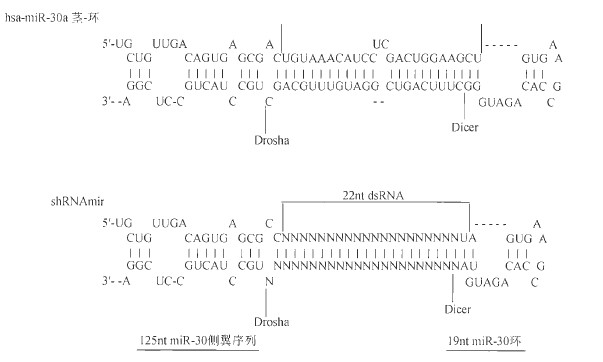
shRNA 。shRNA 可以作为单链RNA 分子转录形成,与含有19 ~ 29 个核苷酸的" 茎”结构和4 ~ 15 个核昔酸“环”结构的前体rniRNA C pre-miRNA ) 类似。转录后,shRNA 由细胞核转运至细胞质, 在细胞质中,“环”结构被Dicer 酶切割产生siRNA
shRNAmir。 目前,通过将人pre-rniR-30 的茎序列替换为所需的siRNA 序列可以构建shRNArnir (图3) 。这样, siRNA 被植入天然pre-miRNA 之中,实现Drosha和Dicer 酶对siRNA 的有效切割, 最终促进siRNA 向导链与成熟RISC 的相互作用。与标准shRNA 相比, shRNAmir 能对靶标进行更高效的抑制(约提高12 倍)。因此,shRNArnir 被称为“第二代shRNA”
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享