慢病毒载体的构建:
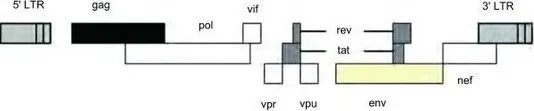
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录并包装RNA到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
慢病毒感染贴壁细胞实验步骤:
1.提前一天细胞铺板
提前一天种植细胞,以感染时细胞融合度在50%左右为宜
- 感染实验
⑴将EnvirusTM-LV用无血清稀释液稀释
⑵将病毒浓缩液用无血清稀释液稀释
注:由于病毒浓度情况不同,具体病毒浓缩液用量酌情依据常规用量,建议进行和增强剂配合的梯度实验。
⑶将增强剂稀释液和病毒稀释液充分混合,4℃静置15分钟。
⑷上述混合液加入到含完全培养基的细胞上,37℃培养8小时后观察细胞状态,如没有明显变化,不要更换培养基,继续培养24小时后常规更换培养基。由于慢病毒感染较慢,一般在感染96小时后观察结果。
感染后的细胞检测方法
1、荧光初步检测
若有荧光,则表示病毒感染成功,但并不能确定目的基因是否整合到细胞中,待进一步检测,荧光有强弱之分,与病毒加入的量有关。
2、RNA的提取及RT-PCR检测
3、蛋白提取及Western检测
在慢病毒感染细胞过程中,会遇到哪些问题呢?
1. 在细胞感染时,MOI是一个非常重要的指标,如何确定MOI值呢?
MOI=(病毒滴度×病毒体积)/细胞数目
感染条件及MOI的选择原则:
(1) 在细胞形态不受影响的情况下尽可能用少的病毒感染细胞
(2) 选择感染效率80%左右的作为最佳感染条件
通过细胞感染预实验可以知道慢病毒对细胞的最佳感染条件,来确定细胞的MOI,进行正式实验。
2. 如何解决细胞难感染的问题?
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,可以通过添加病毒感染增强液来显著提高转染效率。EnvirusTM-LV试剂是英格恩生物公司最新研发合成的新型纳米聚合物病毒感染增强试剂
此外,对于悬浮细胞,可采用离心感染方法,减少病毒感染时的体积,从而进一步提高感染效率。如将细胞培养板密封后,用平角转子离心机1000g离心1h,再放回培养箱中正常培养。
除了难感染外,加入慢病毒后,细胞死亡也是科研的又一拦路虎。
3. 加入慢病毒后,细胞死亡很厉害,该如何处理?
如果不幸,遇到了细胞死亡的情况!怎么办?
调整并降低感染的MOI值,并且在感染后4小时、8 小时、12 小时对细胞进行观察;若发现细胞状态变差时,则需要立刻对细胞进行换液操作,使用新鲜的完全培养液替换病毒感染培养液。
慢病毒的应用:
1. 慢病毒载体介导的RNAi
2. 在肿瘤治疗中的应用
3. 神经系统疾病中的应用
已有大量研究工作表明应用慢病毒载体表达多种神经系统疾病的相关基因,在帕金森病、老年痴呆症、脊髓受损等多种疾病的动物模型中进行长期治疗,已取得良好的效果。
4. 转基因动物模型构建
参考文献:《慢病毒载体及其研究进展》
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享
