病毒转染包括以下步骤:1构建载体 2包装提纯病毒 3感染靶细胞。以慢病毒为例。
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。
一、慢病毒载体构建原理:
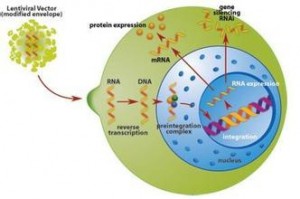
慢病毒载体的包装系统一般由两部分组成,即包装成分和载体成分。包装成分由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白;载体成分则与包装成分互补,即含有包装、逆转录和整合所需的顺式作用序列,同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。将包装成分与载体成分的多个质粒共转染包装细胞,即可在细胞上清中收获携带目的基因的复制缺陷型慢病毒载体颗粒。
慢病毒表达载体包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基因转导效率,而且目的基因整合到宿主细胞基因组的几率大大增加,这就为RNAi,cDNA 克隆以及报告基因的研究提供了一个有利的途径。对进行稳转细胞株的筛选,为活体动物模型实验提供高质量的包含目的基因的病毒液提供基础。
二 、慢病毒载体构建及包装流程:
(一) 实验流程(1和2为并列步骤)
1.慢病毒过表达质粒载体的构建
设计上下游特异性扩增引物,同时引入酶切位点,PCR(采用高保真KOD酶,3K内突变率为0%)从模板中(CDNA质粒或者文库)调取目的基因CDS区(coding sequence)连入T载体。将CDS区从T载体上切下,装入慢病毒过表达质粒载体。
2.慢病毒干扰质粒载体的构建
合成siRNA对应的DNA颈环结构,退火后连入慢病毒干扰质粒载体
3. 慢病毒载体的包装与浓缩纯化
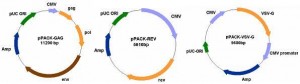
制备慢病毒穿梭质粒及其辅助包装原件载体质粒,三种质粒载体分别进行高纯度无内毒素抽提,共转染293T细胞,转染后6 h 更换为完全培养基,培养24和48h后,分别收集富含慢病毒颗粒的细胞上清液,病毒上清液通过超离心浓缩病毒。
(二) 实验材料:慢病毒载体、包装细胞和菌株
该病毒包装系统为三质粒系统,组成为pspax2, pMD2G, pLVX-IRES-ZsGreen1/pLVX-shRNA2。其中质粒上的ZsGreen1表达框能表达绿色荧光蛋白(GFP)。
细胞株 293T,慢病毒的包装细胞,为贴壁依赖型成上皮样细胞,生长培养基为DMEM(含10% FBS)。贴壁细胞经培养生长增殖形成单层细胞。
菌株大肠杆菌菌株DH5α。用于扩增慢病毒载体和辅助包装载体质粒。
三、慢病毒转染细胞实验方法
1.提前一天细胞铺板
提前一天种植细胞,以感染时细胞融合度在50%左右为宜(悬浮细胞根据需要调整,不要采用过高的细胞密度)。
- 感染实验
⑴将EnvirusTM-LV用无血清稀释液稀释(用量参见下表),充分混匀,制成增强剂稀释液。
⑵将病毒浓缩液用无血清稀释液稀释(用量参见下表),充分混匀,制成病毒稀释液。
注:由于病毒浓度情况不同,具体病毒浓缩液用量酌情依据常规用量,建议进行和增强剂配合的梯度实验。
⑶将增强剂稀释液和病毒稀释液充分混合,4℃静置15分钟。
⑷上述混合液加入到含完全培养基的细胞上,37℃培养8小时后观察细胞状态,如没有明显变化,不要更换培养基,继续培养24小时后常规更换培养基。由于慢病毒感染较慢,一般在感染96小时后观察结果。
表1 不同细胞培养容器推荐用量
| 细胞培养容器 | 表面积(cm2) | 表面积相对于24-well比率 | 每孔EnvirusTM-LV用量 | 每孔稀释液用量 | 每孔培养基总量 |
| 96-well | 0.3 | 0.2 | 0.5-1.5μl | 10μl | 100μl |
| 48-well | 0.7 | 0.4 | 1-3μl | 15μl | 200μl |
| 24-well | 1.9 | 1 | 2.5-7.5μl | 25μl | 500μl |
| 12-well | 3.8 | 2 | 5-15μl | 25μl | 1ml |
| 6-well/35-mm | 10 | 5 | 10-30μl | 50μl | 2ml |
| 60 mm/T25 flask | 21 | 10 | 25-75μl | 125μl | 5ml |
| 100 mm | 58 | 30 | 75-225μl | 250μl | 15ml |
扫描二维码,随时阅读沟通。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享